ピリミノバックメチルの発見経緯

ピリミノバックメチルは、ALS阻害作用を示す除草剤であり、その研究は1984年6月に合成されたピリミジニルカルボキシ系(PC系)化合物に端を発している。1988年の春から夏にかけて、PC系プロジェクトは従来のサリチル酸を中心に展開するチーム以外に、安息香酸に代わるヘテロ環カルボン酸タイプおよび脂肪酸タイプを展開するチームの3つに分かれていた。
従来の安息香酸タイプの展開は、エステル残基や6-位水酸基の修飾を主としたものであり、S-ブリッジ化以降ブレークスルーはないままであった。こうした状況のなか、1988年11月にPC系化合物の研究を見直すチームが発足した。
過去のPC系に関する膨大なデータを前に本プロジェクトのメンバーは1ケ月合成実験を中断して整理・解析を開始した。まず、PC系の薬剤としての構造は4つの重要部品から構成されていると考え、それらの部品が機能や性能にどのように関与しているのかを解析した。その結果、ベンゼン環6-位の置換基の種類こそが、殺草スペクトルや作物への安全性(選択性)に大きく関与することを突き止めた。
ベンゼン環の置換基変換は、母核のもつ性能に対して置換基のもつ性能(例えば活性強度)を加えたり引いたりする加成則が成り立つというイメージでいたところ、むしろ剤全体つまり母核の殺草スペクトルや選択性まで変化させてしまうことに大きな驚きを感じた。一見平凡かつ単純にみえる置換基変換に強い動機付けができた。
そこで4つの部品に分散していた合成展開を6-位置換基に集中することにした。合成的に敬遠したり途中で諦めていた置換基の中に、従来とは異なる殺草スペクトルや作物への特異的な安全性が見出されることを期待し、新たな6-位置換基の候補として解析結果から親水性かつ電子吸引性であり、未だ導入されていないアセタールやアルコールさらにはイミノ化合物等種々の置換基へ誘導可能なアシル基に着目した。
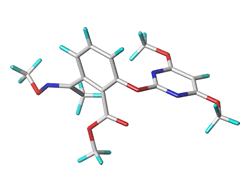
従来6-アシル体はS-ブリッジ体について若干合成されてはいたが、O-ブリッジ体については6-アセチル体のみであった。そこで確実に活性上昇が見込まれる6-ベンゾイル体と6-アセチル体の遊離カルボン酸体の合成を行った。当時サリチル酸部位の6-位に嵩高い置換基を導入したエステルは、隣接基の立体障害からアルカリ加水分解に抵抗すると考えられていた。しかし文献等からの予測で、6-アシル安息香酸エステルはオルト位のアシル基により加水分解はむしろ加速されると考えられ、予測通りメチルエステルは室温で簡単に加水分解されたのである。こうして得られた6-アセチルの遊離カルボン酸体は高い除草活性を示し、畑作土壌試験でダイズに不十分ではあるが選択性が見られた。さらに選択性の発現を期待して6-アシル基の周辺を修飾した。-ラクタム環等、医薬ではアシル基の代わりにオキシイミノ基を導入して同様な生理活性を示す例が紹介されていた。そこでカルボニル基と生物等価性のあるイミノ基に着目した。
見直しプロジェクトが発足して以来およそ9ケ月後、スクリーニング担当者から「イミノ基を導入した化合物にイネ、ヒエ選択性のある剤がある。」と興奮した口調の電話が掛かってきた。ピリミノバックメチル発見の第一報である。
目標を選択性の追求に単純化し、リード化合物のデザインと機能の分析結果から選択性を出せる部位はここだと割り切って考えたことがピリミノバックメチル発見に結び付いたと思われる。
